Конструктивная математика
Акимов О.Е.
25. Модель сильной связи
В табл. 24 приведен фрагмент Периодической таблицы химических элементов с указанием конфигурации внешних электронных оболочек. Эти сходные по конфигурации элементы образуют основную массу полупроводниковых материалов, использующихся в современной микроэлектронике.
Таблица 24
II III IV V VI — — C
2s22p2— — — Al
3s23pSi
3s23p2P
3s23p3S
3s23p4Zn
3d104s2Ga
3d104s24pGe
3d104s24p2As
3d104s24p3Se
3d104s24p4Cd
4d105s2In
4d105s25pSn
4d105s25p2Sb
4d105s25p3Te
4d105s25p4Главными из них являются: кремний — Si, германий — Ge, арсенид галлия или мышьяковый галлий — GaAs (латинское название мышьяка As — Arsenicum), антимонид индия или сурьмянистый индий — InSb (латинское название сурьмы Sb — Stibium), сульфид цинка или цинковая обманка — ZnS (латинское название серы S — Sulfur), селенид цинка — ZnSe (латинское название селена Se — Selenium), теллурид кадмия CdTe — (латинское название теллура Te — Tellurium), фосфид алюминия — AlP (латинское название фосфора P — Phosphorus), а также аналогичные указанным соединения элементов из III и V, II и VI групп Периодической таблицы — AlAs, AlSb, InP, InAs, GaSb, GaP, ZnTe CdS, CdSe. Кроме того, к полупроводникам относятся другие соединения: теллурид и сульфид свинца (PbTe и PbS), карбид кремния (SiC), закись меди Cu2O и прочие. Существуют также полуметаллы, у которых зона проводимости находится ниже валентной зоны, т.е. эти соединения имеют отрицательное значение для ширины запрещенной зоны, например, для соединения HgTe ширина запрещенной зоны равна Eg = – 0,3 эВ, но этот материал не особенно интересен микроэлектроникам.
Алмаз C и серое олово α-Sn (есть еще белое олово β-Sn с иной конфигурацией атомов) относятся скорее к диэлектрику и проводнику, соответственно, чем к полупроводникам, хотя они имеют сходное с указанными полупроводниками строение энергетических уровней. Вообще, отличие полупроводников от проводников и диэлектриков состоит в следующем:
1) сопротивление полупроводников падает с ростом температуры, т.е. они имеют отрицательный температурный коэффициент, у проводников, наоборот, этот коэффициент положительный;
2) значение удельного сопротивления у полупроводников лежит в пределах 10–2 < ρ < 108 [Ом · см] при комнатной температуре, ниже этого значения имеют диэлектрики, выше — проводники;
3) у металлов практически отсутствует запрещенная зона (ЗЗ), отделяющая зону проводимости (ЗП), где носители заряда абсолютно свободны, от валентной зоны (ЗВ), где носители заряда связаны с ядрами атомов; ширина ЗЗ (Eg) для полупроводников лежит в пределах от 0,1 электроновольта (эВ) до 3,0 эВ, ниже этого значения имеют диэлектрики, выше — проводники (табл. 25);
4) проводимость полупроводников чувствительна к свету, температуре, радиации, наличию примеси или дефектов в решетке; любая энергия E > Eg = Ec – Ev, которая каким-либо образом сообщена электронам и дыркам, вызывает электрический ток в полупроводнике.Проводимость полупроводников определяется концентрацией носителей заряда и их подвижностью. Подвижностью называется средняя скорость перемещения носителей тока, которая сообщается им электрическим полем напряженностью в 1 В/см. Величина подвижности электронов μe вместе с шириной ЗЗ Eg для некоторых проводников приведены в табл. 25. Подвижность дырок μh, как правило, меньше подвижности электронов, например, для алмаза она равна μh = 1200, для кремния μh = 500, для антимонида индия μh = 750, фосфида индия μh = 150 [см2/В·с].
Таблица 25
Полупров. Eg , эВ μe , см2/В·с α-Sn 0,0 — InSb 0,2 77090 InAs 0,4 28900 Ge 0,7 3470 GaSb 0,8 4800 Si 1,1 1300 InP 1,3 4330 GaAs 1,5 7700 CdTe 1,6 — AlSb 1,7 190 CdSe 1,8 — AlAs 2,2 240 GaP 2,4 290 ZnTe 2,4 — AlP 2,6 70 CdS 2,6 — ZnSe 2,7 — ZnS 3,8 — C 5,4 1800 На проводимость полупроводников в значительной степени влияет примесь, так как это приводит к резкому повышению концентрации носителей тока. Так, добавление одного атома бора на 100 тыс. атомов кремния увеличивает проводимость последнего в тысячу раз. Примесь бывает акцепторной и донорной; в качестве акцептора для четырехвалентного германия и кремния выступают трехвалентные атомы бора, алюминия, галлия или индия; в качестве же донора — пятивалентные атомы фтора, мышьяка или сурьмы. Однако, увеличивая концентрацию носителей тока, примесь несколько снижает их подвижность за счет дополнительного рассеяния на донорных или акцепторных центрах. Донорные и акцепторные уровни лежат в ЗЗ, причем донорные вблизи дна ЗП, а акцепторные вблизи потолка ЗВ, что приводит к очень малым энергиям активации дырок и электронов (акцепторы поставляют дополнительные дырки, доноры — электроны).
Существование устойчивой химической связи между атомами кристаллической решетки названных полупроводников обусловлено тем, что полная энергия для данной пространственной конфигурации положительно заряженных ионов и внешних электронов всегда меньше, чем для любой другой конфигурации, включая случай, когда атомы разнесены на бесконечно большое расстояние друг от друга. Аллотропией или полиморфизмом называют существование одного и того же вещества в различных структурных модификациях. Например, углерод имеет четыре аллотропии: алмазную (кубическая структура решетки), графитовую (гексагональная структура), карбиновую (линейная структура), фуллереновую (сферическая структура). Сульфид цинка ZnS может образовать кубическую (цинковая обманка) и гексагональную (вюрцит) структуры. Олово имеет две модификации: при температурах ниже 17° С оно существует в α-модификация (серое олово), при более высоких температурах оно принимает β-модификацию (белое олово). Оловянные изделия, сделанные из белого олова, при охлаждении рассыпаются. Это явление получило название оловянной чумы. Все без исключения полупроводники при определенном технологическом режиме (главным образом, это зависит от давления и температуры) могут находиться в аморфном, т.е. в некристаллическом состоянии.
Разность энергий между совокупной энергией изолированных атомов и суммарной энергией для конкретной конфигурации атомов как раз и образует энергию химической связи кристаллической решетки. Разделив эту энергию на число пар атомов решетки, мы получаем величину энергии химической связи, которая возникает между соседними атомами. Обычно величина этой энергии для полупроводников соизмерима с энергией ширины запрещенной зоны. Можно сказать и по-другому: энергия связи равна разности потенциальных энергий изолированных атомов и связанной системы электронов за вычетом дополнительной кинетической энергии, которая возникает в результате образования новой локализации электронов на гибридных оболочках ковалентной связи. Говорим «ковалентной связи», поскольку в указанных полупроводниках преобладает именно эта химическая связь из пяти возможных, к которым, помимо ковалентной, относятся ван-дер-вальсова, водородная, металлическая и ионная связи, правда, немалый элемент ионной связи для соединений элементов из III и V, II и VI групп непременно присутствует. Степень ионизации ковалентной связи указана в табл. 26, которая взята из работы [47, с. 139]. Ионная связь, подобно металлической, не проявляет свойство насыщаемости, характерное для ковалентной связи. Ковалентная связь является сильной связью, например, величина ее для алмаза составляет 3,6 эВ на атом, а для кремния и германия 1,8 эВ и 1,6 эВ, соответственно.
Таблица 26
Химическая связь Степень ионизации Si — Si 0,00 Ge — Ge 0,00 Ga — Sb 0,26 Ga — As 0,32 In — Sb 0,32 In — As 0,35 In — P 0,44 Zn — Te 0,61 Zn — S 0,62 Zn — O 0,62 Zn — Se 0,63 Cd — Te 0,67 Cd — S 0,69 Cd — Se 0,70 Cu — Cl 0,75 Mg — O 0,84 Ag — Cl 0,86 Na — Cl 0,94 Rb — F 0,96 Из табл. 24 видно, что элементы, образующие основные полупроводники микроэлектроники, имеют следующие орбитальные структуры: s2, s2p, s2p2, s2p3 и s2p4. При образовании любой химической связи: Si — Si, Ga — As, Zn — S и т.п. участвует одинаковое число электронов. Глубоко залегающие электроны d-оболочки в образовании ковалентной связи, как правило, не участвуют. Обобществление электронов, находящихся на внешних s- и p-орбиталях, которые локализуются в новые, так называемые гибридные орбитали, считается основным признаком ковалентной или гомополярной (в отличие от ионной или гетерополярной) связи. Полупроводниковые свойства материалов определяются скорее ближним порядком, т.е. именно конфигурацией химической связи, чем дальним порядком, т.е. далекими соседями по кристаллической решетке. Металлическая связь отличается от ковалентной тем, что степень обобществления электронов у них намного выше; орбитали настолько делокализуются, что образуют одно большое облако электронного газа. Такое единое коллективное состояние носителей заряда не образует пространственно ориентированных связей, которые имеются у ковалентных связей.
Элементам IV группы не хватает четырех электронов до полного насыщения оболочек их атомов. Гибридная связь, за счет обобществления электронов, насыщает оболочки недостающими электронами. Ковалентная связь образуется парами электронов, взятых по одному от каждого атома. Если число электронов, взятых с p-орбитали, больше для одного атома, чем для другого, как это имеет место для элементов III и V, II и VI групп, то возникает ионная составляющая в ковалентной связи. Атомы с почти заполненными оболочками, например NaCl и RbF (табл. 26) образуют связи ионного типа, ковалентная составляющая в них почти отсутствует.
Прочную ковалентную связь с энергией в 4,5 эВ на атом образуют атомы водорода, имеющие по одному электрону на s-орбитали. Молекула водорода H2, в зависимости от направления спинов, может образовывать σ- и σ*-орбитали. По мере сближения атомов водорода с электронами, у которых спины направлены в противоположные стороны (↑↓), возникает обменное взаимодействие с образованием гибридной σ-орбитали, энергия которой отрицательна. Так как энергия такого обменного взаимодействия понижает общую энергию системы, то молекула H2 является стабильной, а ее σ-состояние называется симметричным S(↑↓). Напротив, при сближении двух атомов с электронами, у которых спины направлены в одну сторону (↑↑), вступает в силу принцип Паули, согласно которому на орбитали не могут находиться два электрона с одинаковыми квантовыми числами. Обменная энергия в такой системе является величиной положительной, следовательно, молекула H2 не будет уже стабильной; ее σ*-состояние называется антисимметричным с конфигурацией спинов A(↑↑).
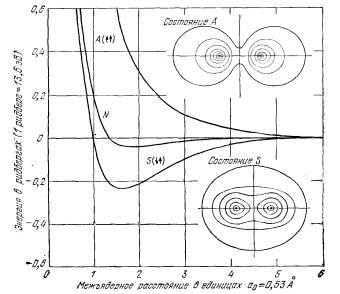
Рис.28
На рис.28, взятом из работы [47, с. 140], показаны три кривых изменения энергии связи в зависимости от расстояния между двумя атомами водорода. Помимо кривой для симметричного и антисимметричного состояний, на рисунке приведена кривая N, построенная на основании классического расчета с использованием плотности заряда в свободных атомах. Здесь же на рисунке приведены плотности распределения заряда для S(↑↓) и A(↑↑) состояний. Видно, что для антисимметричного состояния электронное облако почти распалось на две изолированные части.
Рис.29
Для молекулы водорода разрыхляющая σ*-орбиталь существовать не может, но она существует в полупроводниковых кристаллах, где помимо антисимметричных σ*-состояний могут возникать достаточно прочные симметричные σ-состояния, а также π-состояния (рис. 29, [48, с. 200]). На рис. 29 а и б показаны конфигурации σs- и σs*-состояний от исходных s-состояний; на рис. 29 в и г — конфигурации σy- и σy*-состояний от исходных p-состояний; на рис. 29 д и е — конфигурации πy- и πy*-состояний от исходных p-состояний.
Рис.30
Образование молекулярных σ- и π-орбиталей показано на рис. 30: исходная связь типа Si — Si показана на рис. 30а, типа Ga–As — на рис. 30б; рис. 30в демонстрирует промежуточную перестройку электронов, а рис. 30г — окончательную, которая будет одной и той же для обоих типов связей. На рис. 30д показаны энергетические уровни связи типа Si–Si, когда энергии s- и p-орбиталей одинаковая, а на рис. 30е — связь типа Ga–As, когда энергия s- и p-орбиталей различная; белые кружочки означают начальное положение электронов, темные — конечное.